Російські вчені дослідили різноманітність білкових роторів.
Робота опублікована у журналі PROTEINS: Structure, Function, and Bioinformatics. АТФ-синтаза використовує потенціал на мембрані для синтезу молекул аденозинтрифосфату (АТФ) — універсального «паливного елемента» живих систем. Цей фермент можна порівняти з електричним мотором: у нього є нерухома частина — статор і обертовий — ротор, який також називають с-кільце. Іони, що переносяться АТФ-синтазою через мембрану, сприяють обертанню ротора і синтезу АТФ статором. Сам ротор складається з повторюваних частин (с-субодиниць), кількість яких визначає, скільки іонів проходитиме через мембрану за один оберт і якого потенціалу достатньо для роботи білка.
Відомі АТФ-синтази, що містять від восьми до 17 с-субодиниць. рентгенівську кристалографію або кріо-електронну мікроскопію. Однак розвиток методів машинного навчання призвів до створення ряду проривних підходів, у тому числі для прогнозування білкових структур. Розробники найбільш відомого з них — AlphaFold — у 2024 році були удостоєні Нобелівської премії з хімії. При цьому звичайний AlphaFold не дуже добре працює з великими білковими комплексами, до яких належать і АТФ-синтази.
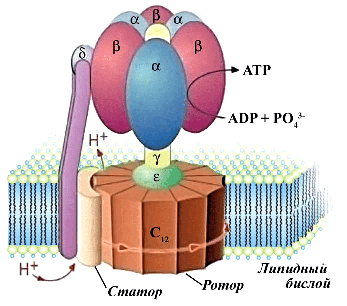
У своїй роботі дослідники з МФТІ запропонували новий підхід на основі AlphaFold, який дозволив впевнено прогнозувати кількість субодиниць у білкових комплексах з обертовою симетрією. Для відомих даних кореляція між прогнозом і експериментальними значеннями перевищила 90 відсотків. Більш того, підхід виявився дуже швидким, завдяки чому стало можливим оцінити кількість субодиниць в АТФ-синтазах дуже різних живих організмах.
«Найбільш несподіваним у наших результатах є прогноз існування в природі мікроорганізмів з дуже великим с-кільцем у АТФ-синтаз, в якому може бути до 27 повторюваних субодиниць! Раніше в експериментах вчені знаходили максимум 17 с-субодиниць. Що важливо, моделювання методом молекулярної динаміки підтверджує результати цих прогнозів», — говорить Степан Осипов, перший автор опублікованої роботи, аспірант Фізтех-школи фізики та досліджень імені Ландау МФТІ.
Навіщо природі потрібні такі незвично великі с-кільця, якщо більш «стандартні» ротори також демонструють високу ефективність? Відповідь на це питання тісно пов'язана з тим, в яких умовах живуть ці організми. Можливо, вони існують при високих температурах або в агресивних середовищах, в яких постійно втрачають іони через свої мембрани. Або справа може бути в малому енергетичному потенціалі на мембрані — тоді висока кратність повторень у с-кільці покликана краще «ловити» рідкісні протони або іони натрію. Подібні великі ротори «витратять» більше протонів за один оберт, але дозволять синтезувати АТФ при значно менших трансмембранних потенціалах. Щоб перевірити ці припущення, знадобляться експериментальні дослідження реальних мікроорганізмів, у яких за розрахунками повинні бути такі незвичайні с-кільця АТФ-синтаз.
«Це також означає, що для багатьох областей біотехнології відкриваються нові можливості. Наприклад, якщо навчитися конструювати молекулярні “двигуни” з заданими параметрами, можна цілеспрямовано налаштовувати ефективність енергетичного обміну в клітинах, створювати мікроорганізми для виробництва різних сполук в умовах, де традиційні штами не виживають», — коментує Олексій Власов, старший науковий співробітник, в.о. завідувача лабораторії молекулярної клітинної біології та оптогенетики МФТІ.
«Наша робота підкреслює важливість обчислювальних алгоритмів на основі машинного навчання та штучного інтелекту в сучасній структурній біології, а також відкриває нові можливості для пошуку цікавих білків у геномних даних і інженерії нових білків з заданими властивостями», — підсумовує Іван Гущин, виконавчий директор Центру досліджень молекулярних механізмів старіння та вікових захворювань МФТІ.
Робота виконана за підтримки Російського наукового фонду та Міністерства науки і вищої освіти Росії.